围绕仿制药一致性评价及新药研究,钛和医药在原料药、固体制剂、注射剂的质量研究方面提供专业服务,以符合全球药政法规和数据完整性为前提,以专业的技能和完善的质量体系为基础,以客户为导向,一切为了信任,为药品的质量提升保驾护航,为人类健康尽力尽责!
原料药质量研究全套服务
制剂质量研究全套服务
基因毒性杂质残留评估检测服务
元素杂质评估检测服务
未知杂质结构解析和杂质谱研究
新药化合物质量研究服务
检验检测服务
进出口注册申报服务
同时拥有CMA和CNAS资质,并结合GMP要求实施的质量保证体系,并已通过国家局等机构多次现 场核查
拥有先进的实验室设备,网络版的质谱工作站,确保测试结果准确可靠,可追踪
拥有经验丰富的技术团队,严格遵循CDE,ICH相关指导原则,确保实施法规追随
报告实行终身负责制
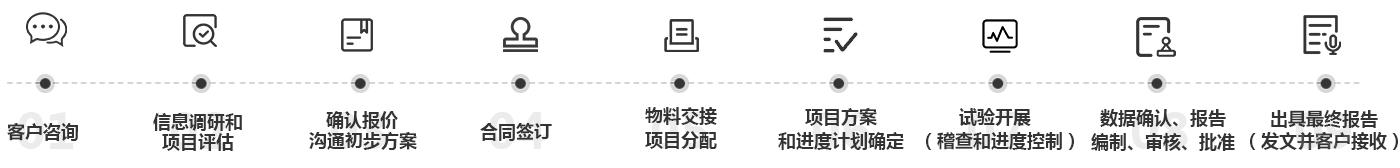
客户咨询:质量研究、申报项目咨询
信息调研和项目评估:委托方准备相容性信息调研表,根据客户需求,结合实际情况,对按期完成任 务需要的资源配置(人员安排、物料准备)等进行评估
确认报价、沟通初步方案:按照委托方需求,设计初步试验方案(包括稳定性试验),确认报价
合同签订
物料交接、项目分配:委托方备好项目所需样品,标准品及其COA,MSDS,并将样品、标准品及其 COA,MSDS交由样品管理员收样保管;试验单位分配项目负责人,QA,实验员
项目方案和进度计划确定:项目负责人根据项目要求设计方案和进度计划,并交由质量保证部门和委 托方审阅后确认
试验开展(稽查和进度控制):项目负责人批准项目计划后进行正式试验;质量保证部门稽查项目过 程,项目管理部门监督项目进度
数据确认、报告编制、审核、批准:项目负责人审核核试验数据,编写报告草稿,并交由质量保证部 门和委托方审阅
出具最终报告(发文并客户接收):项目负责人签字出具最终报告,发文委托方结束项目。原始数据 及一份最终报告公司存档。