临床研究是医药产业无法替代的一步,也是投入时间和资源最多的阶段,是整个医药创新系统最为重要的环节。药品上市前,为确定药物安全性与有效性均需在人体开展药物研究;药品上市后,增加适应症或用药方式,持续观察药物的安全性,也需要持续开展临床研究。药物临床试验分为Ⅰ期临床试验、Ⅱ期临床试验、Ⅲ期临床试验、Ⅳ期临床试验以及生物等效性(BE)试验。2016年《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见》(国办发〔2016〕8号)发布,要求化学药品新注册分类实施前批准上市的仿制药,凡未按照与原研药品质量和疗效一致原则审批的,均须开展一致性评价。要求其中BE研究是仿制药(绝大部分口服制剂、部分特殊注射剂、其他剂型)一致性评价中必不可少的一个环节。
钛和集团生命科学事业部的临床服务团队是一家为药物临床研究提供优质可靠服务的临床试验合同研究组织(CRO)。公司拥有一支优秀的临床试验相关技术队伍,包含临床运营、数据管理和统计分析、SMO和生物分析的团队,可以承接临床试验方案设计、临床试验质量监查、临床数据管理、统计分析、SMO服务、生物分析、临床试验稽查等服务,旨在仿制药质量和疗效一致性评价工作中为国内制药企业和临床试验机构提供“专业、规范、优质、可靠”的一体化全程服务,为我国制药行业的发展做出自己的贡献。
医学撰写
临床试验项目管理和质量监查
临床数据管理
统计分析
SMO服务
临床试验稽查
生物分析
项目管理
从医学撰写到数据管理,满足临床研究各个环节, 不再将业务分包,保证试验质量符合GCP要求;
价格预算透明合理,权责清晰;
研究团队具备丰富的经验、战略规划及统筹能力;
行业口碑好,顾客满意度>95%;
质量管理体系
常规类SOP;
项目管理SOP;
临床监查SOP;
数据分析SOP;
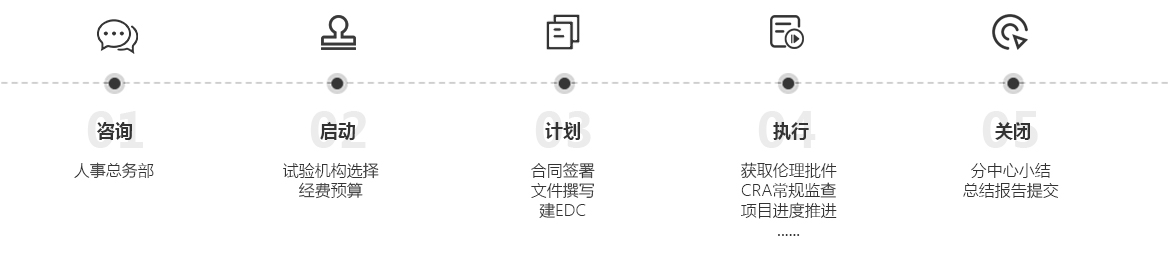
咨询:人事总务部
启动:试验机构选择
计划:合同签署文件撰写建EDC
执行:获取伦理批件CRA常规检查项目进度推进
关闭:分中心小结总结报告提交
临床团队成立至今,已经承接数十项BE和预BE项目,涉及二十余个品规,已提交注册十余个项目,通过核查和免核查七个项目;同时承接了多个新药和器械临床试验的SMO服务;储备了数十个药物的方案、方法。
项目情况
某他汀类分散片预BE正式BE项目全包 已完成
某抗生素类胶囊预BE正式BE项目全包 己核查
某抗生素类胶囊预BE项目全包 已完成
某复方片剂预BE项目全包 已完成
某心血管类预BE项目全包 已完成
某肠胃类药物正式BE项目全包 待核查/免核查
某头孢类预BE项目全包 已完成
某抗凝血类片剂项目正式BE全包 己完成
某复方片剂正式BE项目全包 已核查
某头孢类缓释片正式BE项目全包 待核查/免核查
某泌尿类药物正式BE项目全包 已核查
某治疗高血压类药物预BE项目全包 已完成
公司与国内多家药企长期合作,典型客户包括浙江金华康恩贝生物制药有限公司、杭州康恩贝制药有限公司、浙江昂利康制药股份有限公司、普洛药业股份有限公司、浙江为康药业有限公司等;合作医疗机构包括:浙江省人民医院、浙江大学医学院附属邵逸夫医院、杭州师范大学附属医院、浙江大学医学院附属第一医院、浙江大学医学院附属第二医院、杭州康柏医院、四川大学华西二院、江苏省中医院、南京市一医院等,并成功助力温州市中医院搭建I期临床试验病房/生物等效性研究(BE)中心。







